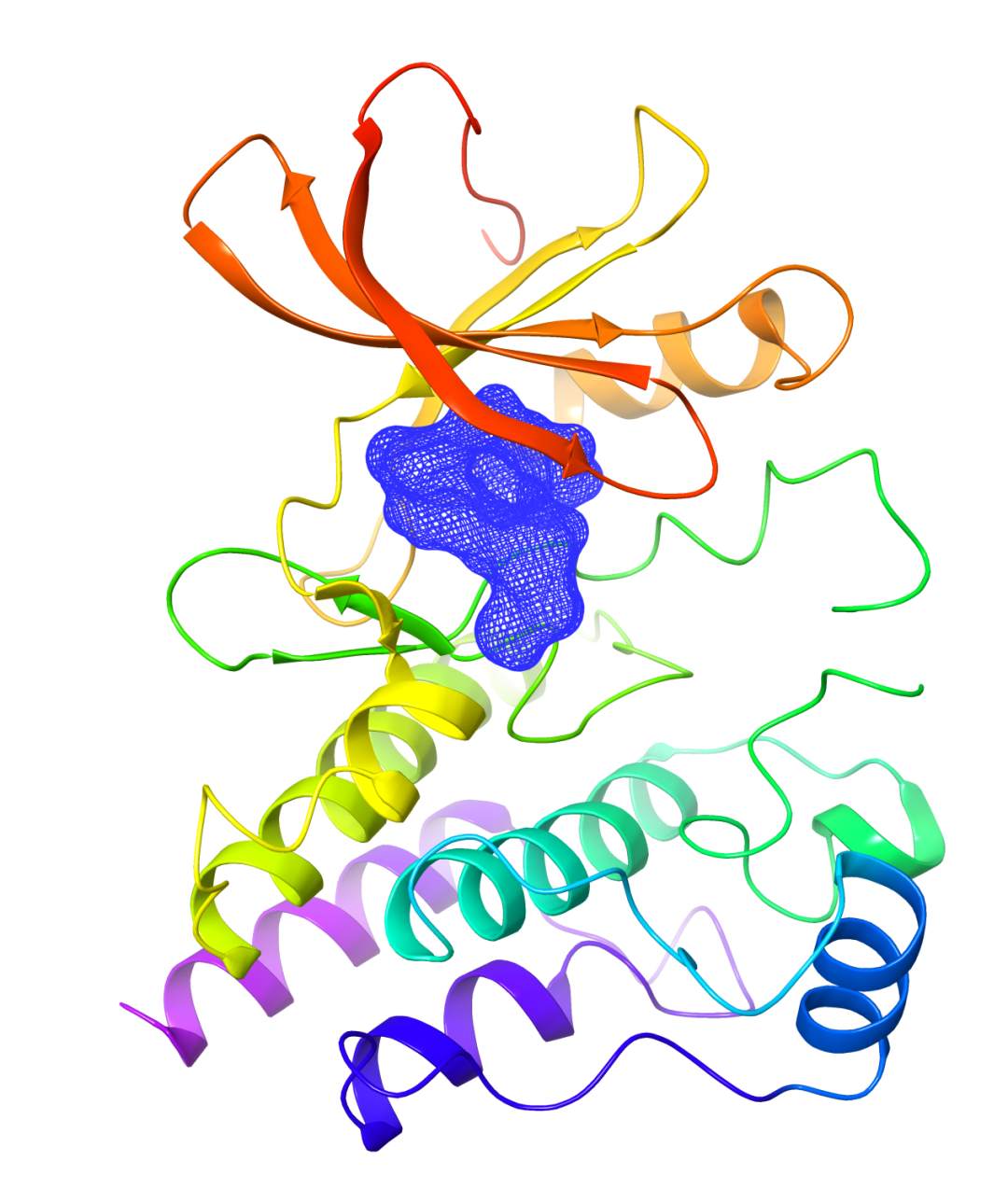
泽布替尼与BTK蛋白复合物晶体结构示意图。
这是全球癌症患者的福音,更是中国新药研发的里程碑:就在刚才,美国食品药品监督管理局(FDA)宣布:中国企业百济神州自主研发的抗癌新药“泽布替尼”,以“突破性疗法”的身份,“优先审评”获准上市!
由此,泽布替尼成为第一个在美获批上市的中国本土自主研发抗癌新药,改写了中国抗癌药“只进不出”的尴尬历史。
新闻多一点
泽布替尼由百济神州的中国科学家团队独立研发,这款新型BTK抑制剂的药物设计旨在最大化对BTK靶点的特异性结合率,同时最大程度地减少脱靶效应。凭借其在一系列临床试验中展现的疗效与安全性,包括在套细胞淋巴瘤等多种B细胞恶性肿瘤中取得的研究数据,2019年1月,泽布替尼获得美国食品药品监督管理局(FDA)授予“突破性疗法认定”(Breakthrough Therapy Designation),用于治疗先前接受至少一次疗法的成年套细胞淋巴瘤(MCL)患者,从而成为首个在FDA获此认定的中国本土研发抗癌新药。
泽布替尼对套细胞淋巴瘤完全缓解率达78%
套细胞淋巴瘤(MCL)是一种侵袭性较强的非霍奇金淋巴瘤,由于早期症状隐匿、较为罕见且不易诊断,多数患者在确诊时通常已经处于晚期,较高的疾病复发率使患者往往面临预后不良的局面,中位生存期仅为3—4年。
研究结果显示,在85位疗效可评估的患者中,接受泽布替尼治疗后,由研究者评估的客观缓解率(ORR)达84%,完全缓解率(CR)达78%。北京大学肿瘤医院淋巴瘤内科副主任、主任医师宋玉琴教授表示,泽布替尼在套细胞淋巴瘤患者中展现了高度的活性,84%的患者达到了客观缓解,超过半数患者达到完全缓解,并且总体耐受。
另一项全球I/II期临床试验中,共入组了包括53位套细胞淋巴瘤患者在内的多种B细胞恶性肿瘤患者。本次更新的试验结果显示,在43位可评估的套细胞淋巴瘤患者中,接受泽布替尼单药治疗后,研究者评估的客观缓解率达85.4%,其中完全缓解率达29.2%,部分缓解率PR为56.3%。
此外,泽布替尼对慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)也表现出了较高的缓解率。慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)是多发于中老年人群的一种成熟B淋巴细胞瘤。慢性淋巴细胞白血病的病程进展相对缓慢,但部分患者可向幼淋巴细胞白血病、弥漫大B、霍奇金淋巴瘤、急淋等其他恶性淋巴增殖性疾病转化。一项在中国开展的单臂、多中心关键II期临床研究中,入组了91位患者,包括82位慢性淋巴细胞白血病患者与9位小淋巴细胞淋巴瘤患者,数据显示,客观缓解率达85%,12个月无进展生存率估计值为87.2%。
治疗华氏巨球蛋白血症客观缓解率达92%
华氏巨球蛋白血症(WM),是一种淋巴浆细胞淋巴瘤,属于一种罕见的惰性B细胞淋巴瘤,仅占所有非霍奇金淋巴瘤的2%,多发于中老年人群,患者确诊时的中位年龄约64岁。
根据百济神州公布的2项泽布替尼在华氏巨球蛋白血症中的研究数据及治疗B细胞恶性肿瘤的安全性数据汇总分析,泽布替尼治疗的客观缓解率达80.8%,主要缓解率达54%,包括23%的非常好的部分缓解(VGPR)。同时,患者耐受总体良好,仅7.7%患者因不良事件中断治疗,未发生致死性不良事件和房颤。研究还纳入26位MYD88野生基因型患者,包括5位初治和21位复发/难治患者,全部接受泽布替尼治疗,MYD88野生基因型患者过去在其他BTK抑制剂中的响应率通常较低,预后效果不甚理想,但此次数据显示,泽布替尼在这类难治患者中仍然能够达到深度缓解。
另一项研究显示,在73例可评估疗效的患者中,泽布替尼治疗华氏巨球蛋白血症的客观缓解率达92%,同时取得了良好的耐受性。
目前,百济神州正在全球范围针对泽布替尼开展共计14项临床研究,包括8项注册性临床试验,其中2项为全球III期头对头临床研究。2018年8月和10月,国家药监局药品审评中心先后受理了泽布替尼用于治疗R/R MCL和R/R CLL/SLL的新药上市申请,两者均被纳入优先审评。2019年1月,泽布替尼获得美国食品药品监督管理局(FDA)授予用于治疗R/R MCL成年患者的“突破性疗法”认定,成为中国首个获得该项认定的自主研发抗癌新药。此前,泽布替尼还曾获FDA授予在华氏巨球蛋白血症中的“快速通道”资格。据目前公布的计划,百济神州将在2019年或2020年初向美国FDA递交泽布替尼的新药上市申请。











 粮食供给安全的要求越来越高
粮食供给安全的要求越来越高
 2022年服贸会增加赞助商层级
2022年服贸会增加赞助商层级
 高标准自贸区网络加快打造
高标准自贸区网络加快打造
 GDP万亿城市进入新一轮的升
GDP万亿城市进入新一轮的升
 长沙实现数字人民币税款缴纳
长沙实现数字人民币税款缴纳
 新车销售由增量市场逐步转向
新车销售由增量市场逐步转向
 中国文旅创新发展 消费市场
中国文旅创新发展 消费市场
 48小时点击排行
48小时点击排行