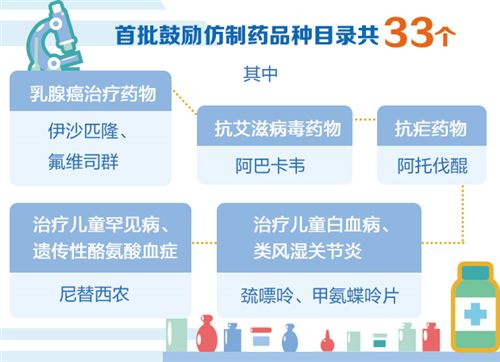
国家卫健委近日印发《第一批鼓励仿制药品目录》,明确列出首批33个鼓励仿制药品种目录,提出各相关部门要按照有关规定,在临床试验、关键共性技术研究、优先审评审批等方面予以支持。
业内人士在接受记者采访时表示,鼓励发展高质量仿制药,能够有效降低患者用药成本,此次出台《目录》意味着仿制药上市按下“快进键”,将激励相关企业进一步加大仿制药生产、销售力度,提高药品生产质量,从而惠及广大患者。
专家介绍,仿制药指与商品名药在剂量、效力、作用以及适应症上相同或趋同的一种仿制品。目前,世界上将有150种以上总价值达340多亿美元的专利药品保护期到期,其他国家和制药厂即可生产仿制药。
之所以要鼓励生产仿制药,根本原因在于正版原研药价格昂贵,特别是一些治疗各种癌症的靶向药物,仿制药价格低很多。此外,由于医药行业特殊性,一种新药从开始研制、申报到临床、销售,最后到普通民众能用上,是一个漫长的过程,要及时解决部分患者“看病贵”问题,仿制药就成了质优价低的不二选择。
但是记者也了解到,在“4+7”带量采购、医保控费、两票制等政策影响下,仿制药面临产品销量、价格大幅下滑压力,部分企业开始调整公司产品布局,摒弃部分仿制药业务,以适应市场发展。恒瑞医药董事长孙飘扬表示,基于投入和产出的衡量,恒瑞医药已经停止了一批仿制药开发项目。
此次鼓励仿制药品目录的发布,为药企仿制药研发指明了方向。“此次《目录》发布释放出了仿制药领域政策将逐步放开的信号,尤其是那些‘临床必需、疗效确切、供应短缺’的药品,国家鼓励仿制和研发的意图非常明显。”有关专家表示。
梳理第一批鼓励仿制药品目录可以发现,与国家卫健委此前公示的“首批鼓励仿制药品目录建议清单”相比,此次鼓励仿制药品种数量由34种减少到了33种,艾滋病治疗药物利匹韦林落选。
在入选的33个品种中,囊括了抗癌药、罕见病药物等多种药物。此外,非索罗定、氟维司群等专利即将到期的原研药也被纳入其中。专家认为,这意味着国内仿制药有了引路指南,有助于企业避免盲目研发,及时调整生产布局。
“随着未来普通仿制药进入微利时代,具有高技术壁垒的仿制药和创新药将成为药企研发方向。”正大天晴药业集团副总裁兼研究院副院长夏春光介绍,第一批鼓励仿制药品目录中的产品富马酸福莫特罗吸入溶液剂、氟维司群注射液、福沙吡坦二甲葡胺注射用无菌粉末等产品正大天晴均在研发,有的已经申报生产。
业内人士分析认为,此次首批鼓励药品目录的发布或将带来仿制药行业新一轮洗牌,具备关键技术、创新技术、综合能力强的企业或能成功研发高质量仿制产品,有望在市场竞争中占据优势。
“中国是仿制药大国,2016年我国仿制药市场规模接近8000亿元,但由于各种原因,仿制药行业大而不强,大部分药企还处于中低端仿制生产阶段,患者对高质量仿制药的需求很大。”医改专家魏子柠认为,下一步,国家或将进一步加大对国产高品质仿制药的政策倾斜力度,提升制药工业的工艺水平和仿制药品质量,推动我国从制药大国向制药强国转变。
关键词: 仿制药提质降价











 粮食供给安全的要求越来越高
粮食供给安全的要求越来越高
 2022年服贸会增加赞助商层级
2022年服贸会增加赞助商层级
 GDP万亿城市进入新一轮的升
GDP万亿城市进入新一轮的升
 长沙实现数字人民币税款缴纳
长沙实现数字人民币税款缴纳
 新车销售由增量市场逐步转向
新车销售由增量市场逐步转向
 中国文旅创新发展 消费市场
中国文旅创新发展 消费市场
 48小时点击排行
48小时点击排行


